ENERGÍA CONTENIDA EN EL ÁTOMO – EL MODELO ESTÁNDAR
Desde fines del siglo XIX, se establece formal y masivamente en el medio científico, que los elementos están formados por partículas denominadas Átomos. El trabajo del naturalista y químico inglés John Dalton (1766-1844), condujo a su clasificación ordenada según sus pesos atómicos o masas atómicas relativas. Parte de este nuevo conocimiento era el supuesto que las reacciones químicas forman compuestos al reordenarse los átomos en nuevas moléculas a partir de los elementos iniciales y que algunas de estas reacciones liberan energía mientras que otras la requieren.
 En 1911, el físico neozelandés Ernest Rutherford (1871-1937) determinó que casi toda la masa del átomo se concentraba en un pequeño núcleo central, que ocupa sólo la diezmilésima parte del diámetro total. Una nube de veloces electrones de carga negativa rodean a este núcleo conformado por protones de carga positiva, estableciendo así un átomo neutro y estable. El reordenamiento de los electrones, expresado en cambios de sus potenciales cinéticos y eléctricos durante las reacciones químicas, determinaría los nuevos elementos que se forman y la energía que se libera en dicho proceso. El perfeccionamiento del modelo atómico descrito anteriormente se debe al mismo Rutherford, quien planteó la existencia de una nueva partícula dentro del núcleo, el neutrón. Esta última, de casi la misma masa del protón, no tiene carga eléctrica siendo neutra. Finalmente, la masa atómica relativa es determinada por el número total de nucleones (protones más neutrones). Las masas atómicas no enteras se explican por la existencia natural de los isótopos, átomos de un mismo elemento con distinto número de neutrones.
En 1911, el físico neozelandés Ernest Rutherford (1871-1937) determinó que casi toda la masa del átomo se concentraba en un pequeño núcleo central, que ocupa sólo la diezmilésima parte del diámetro total. Una nube de veloces electrones de carga negativa rodean a este núcleo conformado por protones de carga positiva, estableciendo así un átomo neutro y estable. El reordenamiento de los electrones, expresado en cambios de sus potenciales cinéticos y eléctricos durante las reacciones químicas, determinaría los nuevos elementos que se forman y la energía que se libera en dicho proceso. El perfeccionamiento del modelo atómico descrito anteriormente se debe al mismo Rutherford, quien planteó la existencia de una nueva partícula dentro del núcleo, el neutrón. Esta última, de casi la misma masa del protón, no tiene carga eléctrica siendo neutra. Finalmente, la masa atómica relativa es determinada por el número total de nucleones (protones más neutrones). Las masas atómicas no enteras se explican por la existencia natural de los isótopos, átomos de un mismo elemento con distinto número de neutrones.
 Así, finalmente el Átomo como lo conocemos hoy en día está compuesto por un núcleo, formado por protones (carga eléctrica positiva) y neutrones (carga eléctrica nula), y un conjunto de electrones (carga eléctrica negativa) que están orbitando alrededor del núcleo. Los elementos químicos se diferencian entre sí por el número de protones del núcleo atómico (por ejemplo, el Hidrógeno tiene un solo protón y el Oxígeno tiene 8), mientras que el número de neutrones determina el isótopo respectivo (por ejemplo, el núcleo del Hidrógeno normal no contiene neutrones, pero el de sus isótopos sí. Un isótopo es el Deuterio, cuyo núcleo consta de un protón y un neutrón, y otro es el Tritio, cuyo núcleo posee dos neutrones y un protón).
Así, finalmente el Átomo como lo conocemos hoy en día está compuesto por un núcleo, formado por protones (carga eléctrica positiva) y neutrones (carga eléctrica nula), y un conjunto de electrones (carga eléctrica negativa) que están orbitando alrededor del núcleo. Los elementos químicos se diferencian entre sí por el número de protones del núcleo atómico (por ejemplo, el Hidrógeno tiene un solo protón y el Oxígeno tiene 8), mientras que el número de neutrones determina el isótopo respectivo (por ejemplo, el núcleo del Hidrógeno normal no contiene neutrones, pero el de sus isótopos sí. Un isótopo es el Deuterio, cuyo núcleo consta de un protón y un neutrón, y otro es el Tritio, cuyo núcleo posee dos neutrones y un protón).
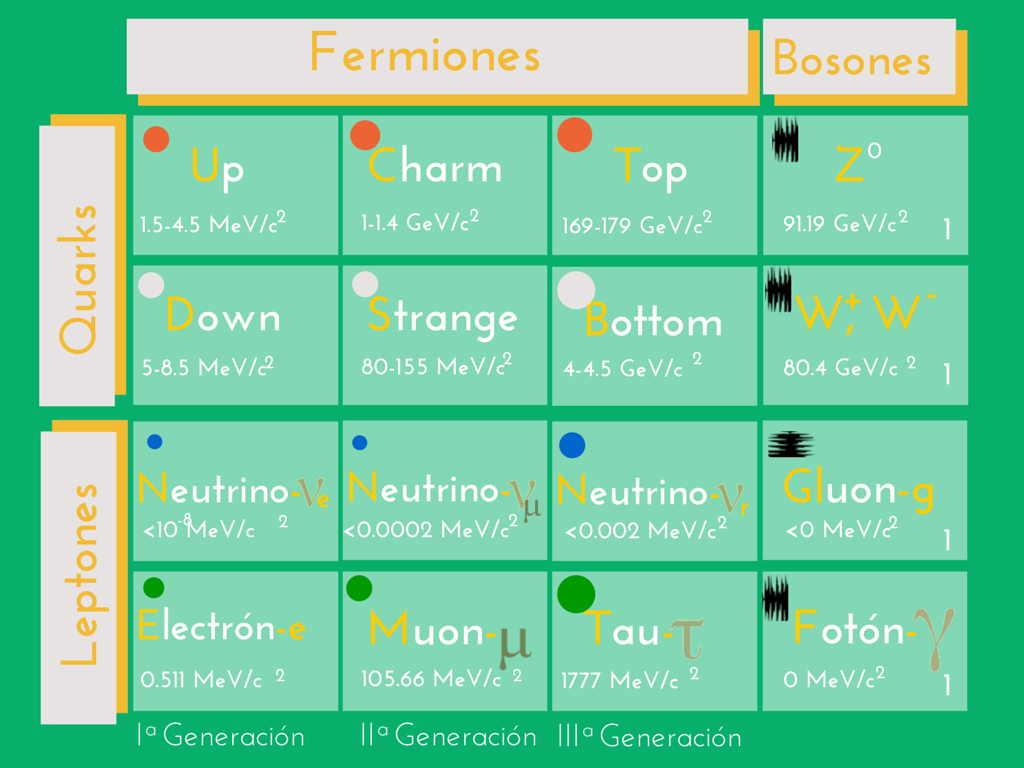
Ahora bien, si nos adentramos mas a fondo en las partículas fundamentales que conforman la Materia, podemos ver que existen básicamente dos tipos de partículas fundamentales: Bosones y Fermiones.
Los Bosones son los transmisores de las fuerzas fundamentales, y los Fermiones se dividen en Quarks y Leptones. Los Quarks y Leptones son partículas elementales de la materia, y existen 12 tipos de estas partículas, 6 Quarks y 6 Leptones.
- Bosones: Z0, W+, W–, Gluón, y Fotón.
- Quarks: Up (u), Down (d), Charm (c), Strange (s), Top (t) y Bottom (b).
- Leptones:Electrón, Muón, Tau, Neutrino electrónico, Neutrino muónico, y Neutrino tau.
Los tres neutrinos, tienen carga eléctrica nula, las restantes 9 partículas tienen carga eléctrica. El electrón, muón y partícula tau tienen la misma carga eléctrica. Tomando a esta carga como patrón y de signo negativo, la carga eléctrica de los quarks Up, Charm y Top es positiva e igual a 2/3 de la carga del electrón, mientras que los quarks Down, Strange y Bottom tienen carga eléctrica negativa e igual a -1/3 de la carga electrónica.
En resumen, la materia está formada de átomos (Ej. H, He, C, etc), los cuales están formados por partículas (electrón, protón y neutrón), y las partículas a su vez de Bosones y Fermiones (Quarks y Leptones) que son partículas fundamentales. Por ejemplo el protón tiene tres Quarks al igual que el neutrón, la diferencia es su configuración. El protón como tiene carga positiva, se compone de dos Quarks Up y un Quarks Down, mientras que el neutrón como no tiene carga se configura de dos Quarks Down y un Quark Up.
Las partículas se ensamblan con quarks, y se llaman colectivamente Hadrones, que pueden ser de dos clases: Bariones o Mesones. Los Bariones están compuestos por tres Quarks o por tres Antiquarks (Ej. protón, neutrón, lambda, etc.); y los Mesones están compuestos por un Quark y un Antiquark (Ej. pion, rho, kaon, etc.). Los Antiquarks son partículas de antimateria de carga opuesta a la materia.
INTERACCIÓN DE LAS PARTÍCULAS FUNDAMENTALES
El modelo estándar del átomo establece que la materia existe por la interacción de partículas fundamentales las cuales pueden ensamblarse, atraerse, repelerse, decaer o aniquilarse. Para que esto suceda interfieren todas las fuerzas conocidas en el universo, que se pueden explicar por medio de 4 interacciones fundamentales:
- Fuerte: Puede ser fundamental o residual. Produce muy fuerte atracción de corto alcance entre Quarks y aglutina Hadrones. El portador es el gluón.
- Débil: Responsable del decaimiento a fermiones más pequeños, actúa sobre Quarks y Leptones. Los portadores son W+, W– y Z0.
- Electromagnética: Produce fuerte repulsión o tracción entre partículas fundamentales, según sus cargas. El portador es el fotón.
- Gravitacional: Es débil frente a las demás fuerzas. Actúa sobre todas las partículas de la materia. El portador supuesto es el gravitón.
La interacción de partículas fundamentales permite explicar cómo se mantiene la integridad del átomo, ya que las partículas de igual carga eléctrica tienden a repelerse y los núcleos atómicos llenos de protones no podrían ser estables sin esta poderosa fuerza que atrae unos a otros a los nucleones. Cuando se unen los átomos, lo hacen por medio de la fuerza electromagnética, la cual enlaza los protones y electrones, al romper ese enlace libera solo un par de eV (electrón volts) de energía por evento, un claro ejemplo es la combustión. Pero si rompemos el enlace del núcleo del átomo, que se encuentra unido por una interacción Fuerte entre Quarks de diferentes Hadrones, se liberaría millones de eV de energía, ya que es un enlace que contiene mayor fuerza y, por ende, energía. Es esta separación que permite obtener una gran cantidad de Energía por medio de la fisión nuclear.
Por ejemplo, para comparar la intensidad de las interacciones entre los componentes básicos de la materia, se observa que la combustión de 1 kg de carbón con 3 kg de oxígeno, libera 30 MJ de energía y disminuye la masa de ambos elementos en una magnitud de 0,0000000001; mientras que la reacción nuclear de 1 kg de U235, libera 8,2 TJ (270.000 veces más) y la masa de uranio disminuye en una magnitud de 0,0001.